实验教案
实训一 Southern 杂交技术
核酸分子杂交包括Southern杂交和Northern杂交。前者是基于核酸的碱基序列互补配对原则,以特定序列的核酸标记探针检测互补的DNA片段的存在;后者是以特定序列的核酸标记探针检测互补的RNA。核酸分子杂交是分子生物学研究中最基本的技术方法之一,其基本原理是序列互补的两个单链核酸片段在适宜的温度和离子强度等条件下按碱基互补原则退火形成双链,因此核酸互补杂交是高度特异的。在进行分子杂交时,待测的DNA或RNA必须转移至固相的支持物上,如在硝酸纤维膜上形成核酸的印迹或玻片上的细胞、染色体附着物,检测DNA时还必须使DNA变性,然后才能与探针进行退火杂交。分子杂交之后,再根据探针上的标记进行检测和观察。本实验介绍Southern杂交的技术方法,至于Northern杂交,与Southern杂交大同小异,可触类旁通。在本实验中, 由于标记探针渗入了生物素, 可利用亲和素与之特异性结合, 再通过偶联在亲和素分子上的辣根过氧化物酶或碱性磷酸酶进行显色反应, 使探针的杂交位点得以显现出来,以便于观察。
【预习思考】
1 论述Southern杂交的原理与步骤。
2 论述Southern和Northern杂交的异同点。
【实训目标】
1 掌握DNA分子杂交的原理和方法。
2 熟悉杂交仪的使用方法。
【实训用品】
1 仪器 分子杂交仪、低温摇床、恒温烤箱、紫外观测仪、取液器、双稳电泳仪、水平电泳槽、恒温水浴锅、暗室、微波炉、凝胶成像仪
2 试剂 Tris、HCl、PVPP、SDS、DTT、SDS、EB、蔗糖、溴酚蓝、琼脂糖、荧光标记探针、石蜡膜、硝酸纤维膜、一次性手套、吸水纸、称量纸、枪头、离心管、铝薄
【实训方案】
(一)实训形式
试液配制、仪器使用、实训记录等,以8人为学习组,每4人一台仪器。
(二)实训要求
每2组各配1组试剂,做1次膜转移。注意在整个操作过程中手不要接触NC膜,转膜时注意排除气泡。显色反应尽量避光或暗中进行,不要超过20分钟,以免背景色太深而影响拍照。由于实验时程较长,环节较多,最好先制作好各实验步骤时间进程,每完成一个步骤后划线标记。
(三)药品配置
1变性液(0.5 mol/L NaOH + 1.5 mol/L NaCl):称取NaOH 10 g和NaCl 45 g, 加水定容至500 mL。
2中和液(1 mol/L Tris-HCl (pH7.4) + 1.5 mol/L NaCl):用800 mL水溶解121 g Tris,加70 mL浓盐酸,调pH至7.4, 再加入89 g NaCl, 加水定容至1000 mL。
3 20× SSC缓冲液(3 mol/L NaCl + 0.3 mol/L柠檬酸钠):在800mL水中溶解175.3 g NaCl和88.2 g 柠檬酸钠,用1 mol/L NaOH调pH至7.0, 加水定容至1000 mL,高压灭菌后备用。
4 50× Denhardt试剂:1g PVP + 1g BSA + 1g 聚蔗糖, 加水定容至100 mL。
5 封闭液:3 g BSA溶于70 mL水中,用浓盐酸调pH至3.0,煮沸20分钟后冷却至室温,用1 mol/L NaOH调pH至7.5,加入洗涤液C 10 mL,用水定溶至100 mL。
6 预杂交液:6× SSC缓冲液(含100 μg/μL 变性鲑鱼精DNA和0.5% SDS)225 mL加50× Denhardt试剂25 mL。
7 PBS缓冲液:NaCl 8g + KCl 0.2g + Na2HPO4 1.44 g + KH2PO4 0.24 g, 加水定容至1000 mL, 调pH至7.4。
8 0.1 mol/L Tris-HCl缓冲液(pH7.5):用800 mL水溶解12.2 g Tris, 加6.0 mL浓盐酸, 调pH至7.5, 加水定容至1000 mL。
9 洗涤液A:2×SSC 250 mL加入0.25 g SDS。
10 洗涤液B:0.1×SSC 250 mL加入0.25 g SDS。
11 洗涤液C:NaCl 5.9 g + MgCl2 0.019 g + Triton X-100 0.05 g , 用0.1 mol/L Tris-HCl缓冲液(pH7.5)溶解后定容至100 mL。
12 洗涤液D:NaCl 2.95 g + Tween-20 0.5 mL, 用0.1 mol/L Tris-HCl缓冲液(pH7.5)溶解后定容至100 mL.
13 亲和素—辣根过氧化物酶溶液:用PBS缓冲液配制,含辣根过氧化物酶2 U/mL,每组配10~15 mL。
14 显色液:125 mg DAB(3,3-二氨基联苯胺)加入0.05 m mol/L Tris-HCl (pH7.6) 250 mL, 再加1% 过氧化氢1 mL. 要求配制时避光, 配制后装于棕色瓶中,现配现用。
【实训操作】
样品点样跑胶---变性、中和---膜转移---烤膜---封闭---预杂交---杂交---洗膜---显色反应。
【实训现象、数据处理与结果、小结与评议】
(一)现象
(二)数据处理与结果
(三)小结与评议
考核与评价
一、操作技能考核
(一)题目
Southern 杂交技术。
(二)考核要点
1. 制备Southern 杂交凝胶和普通电泳凝胶的差异。
2. 做好标记确保凝胶上的DNA条带与转移到膜上的位置完全相同。
3. 毛细管转印法与电转印的优缺点。
4. 设计相应表格,详细记录药品配置与原始操作过程的意义。
5. 文明操作。
(三)仪器
分子杂交仪、低温摇床、恒温烤箱、紫外观测仪、取液器、双稳电泳仪、水平电泳槽、恒温水浴锅、暗室、微波炉、凝胶成像仪
(四)试剂
Tris、HCl、PVPP、SDS、DTT、SDS、EB、蔗糖、溴酚蓝、琼脂糖、荧光标记探针、石蜡膜、硝酸纤维膜、一次性手套、吸水纸、称量纸、枪头、离心管、铝薄
(五)分析步骤
1 取酶切过的DNA样品15 μL加上样缓冲液4 μL、EB 2 μL和溴酚蓝1 μL,混合后于1% 琼脂糖凝胶上电泳1~1.5小时.
2 电泳毕凝胶照相,之后切去凝胶周边无DNA带的部分,并在凝胶的一角切去小块以作记号。
3 将凝胶浸入0.25 N的HCl中脱嘌呤10分钟, 用重蒸水洗凝胶2次各1分钟。
4 变性液浸泡凝胶2次各15分钟,再用中和液浸泡凝胶2次各15分钟。
5 20× SSC缓冲液浸泡凝胶并在室温中静置10分钟(平衡)。
6 膜转移:在一大培养皿内置一玻璃板或塑料平板(离底2-3cm),在板上铺2张宽6-8 cm用20×SSC缓冲液浸湿的滤纸条(要求滤纸条两端接触培养皿底部),将切好的凝胶反扣于滤纸上,四周用石蜡膜封闭,取一稍大于凝胶的硝酸纤维素(NC)膜经20×SSC缓冲液浸湿后覆盖于凝胶上,再盖两层大小相当并经20×SSC缓冲液浸湿的滤纸,倒200~300 mL 20×SSC缓冲液于培养皿中,用石蜡膜封闭凝胶上的滤纸周边至培养皿边缘防止缓冲液蒸发,再在上方放一叠吸水纸,盖上一玻璃板,再压一块500 g左右的重物,转移过液。注意:滤纸—凝胶—NC膜—滤纸之间不能有气泡。
7 烤膜:膜转移结束后取出NC膜并在与凝胶记号的对应处做好标记,用6×SSC缓冲液室温下漂洗5分钟,晾干后用滤纸夹裹好,80 ℃烤膜2小时。
8 封闭:将烤好的NC膜用2×SSC缓冲液浸润后放入杂交袋中(有DNA的一面向上),加入封闭液(5 mL/ 50cm2),在摇床上慢慢摇晃2~4小时。
9 预杂交:倒尽封闭液,将预热至65 ºC的预杂交液加至有DNA的NC膜表面上(0.2 mL/cm2), 赶走气泡, 封口, 65~68 ℃缓慢振荡2~4小时(或使用分子杂交仪,每个杂交瓶放膜2块,加预杂交液10 mL,预杂交2小时)。
10 杂交:将标记探针在95~100 ℃热变性5分钟,加入到65 ℃预杂交液中(1~2 ng/mL),即为杂交液(需随用随配);倾出预杂交袋中的预杂交液,加入杂交液(0.2 mL/cm2),65~68 ℃缓慢振荡过夜(或使用分子杂交仪,每个杂交瓶放膜2块,加杂交液10 mL,杂交4小时以上)。
11 洗膜:取出印迹膜(杂交液可收集再用),用洗涤液A和洗涤液B各洗膜2次,每次5分钟,每次洗涤液的用量不少于200 mL(可用杂交仪)。
12 反应:将印迹膜放入小培养皿或塑料盒内(印迹面向上),加入封闭液15mL浸没,25~30 ℃温育30分钟;弃去封闭液,加入亲和素-辣根过氧化物酶溶液浸没印迹膜,30 ℃温育30分钟,分别用洗涤液C和洗涤液D各洗膜3次,每次3~5分钟(用20 mL洗涤液);加入DAB显色液15~20 mL浸膜,避光反15分钟后,用PBS缓冲液冲洗,终止反应,并拍照记录。
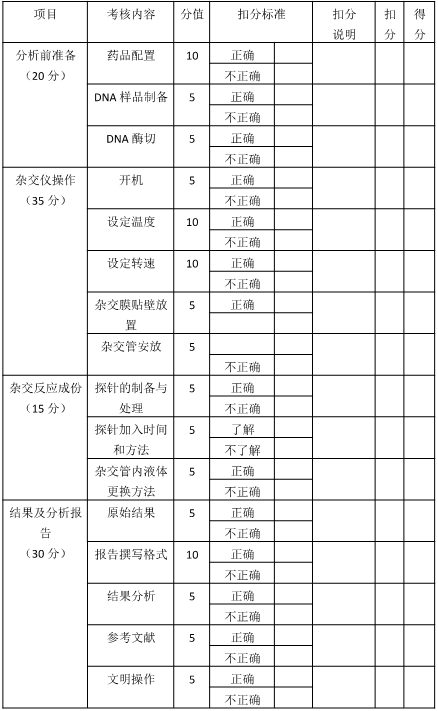
二、技能考核评分表
操作评分细则