实验教案
实训一 Western 杂交
一、实验目的
掌握Western杂交的基本原理、方法和操作技术。
二、实验原理
Western杂交(Western Blot)与Southern或Northern杂交方法类似,但Western Blot采用的是聚丙烯酰胺凝胶电泳,被检测物是蛋白质,“探针”是抗体,“显色”用标记的二抗。经过PAGE分离的蛋白质样品,转移到固相载体(例如硝酸纤维素薄膜)上,固相载体以非共价键形式吸附蛋白质,且能保持电泳分离的多肽类型及其生物学活性不变。以固相载体上的蛋白质或多肽作为抗原,与对应的抗体(第一抗体)起免疫反应,再与酶或同位素标记的第二抗体(以第一抗体为抗原)起反应,经过底物显色或放射自显影以检测电泳分离的特异性目的基因所表达的蛋白质。
Western杂交也称Western印迹(Western bloting), 是检测特异性蛋白质的技术方法, 其基本原理是基于抗原— 抗体的特异性反应, 用特定抗体(第一抗体)与特异性蛋白质(目标抗原)结合, 再用第二抗体与第一抗体(第二抗体的抗原)结合, 利用偶联在第二抗体上的辣根过氧化物酶(HRP)或碱性磷酸酶(AP)催化底物的显色反应, 显示目标抗原的存在。这种利用偶联于抗体上的酶促反应进行显色的Western杂交实际上是一种酶联免疫反应,其操作的主要步骤包括目标抗原的分离和膜转移, 第一抗体与目标抗源结合,第二抗体再与第一抗体结合, 酶促显色反应和拍照记录等步骤。
三、实验材料
待杂交检测的蛋白质样品。
四、仪器设备及用具
分子杂交仪、双稳电泳仪、电转移电泳槽、垂直板电泳槽、微波炉、真空干燥机、电动摇床、摄影装置、冷柜、移液器等。
五、试剂
1.上样缓冲液:将6 g Tris溶于50 mL水中, 加入SDS 2 g、甘油20 mL、溴酚蓝0.05 g,再加入浓盐酸4 mL,调pH至6.8,加水定容至100 mL,冰箱保存备用。
2.30%凝胶母液:丙烯酰胺29 g加甲叉双丙烯酰胺1 g,用水溶解后定容至100 mL,过滤后冰箱中保存备用。
3.分离胶缓冲液:将18.5 g Tris溶于80 mL水中, 加浓盐酸2 mL, 再调pH至8.8, 加水定容至100 mL。
4.浓缩胶缓冲液:将12.1 g Tris溶于60 mL水中, 加浓盐酸8 mL, 再调pH至6.8, 加水定容至100 mL。
5.10×电极缓冲液:Tris 30 g加甘氨酸141 g和SDS 10 g,加水定容至1000 mL,调pH至8.3。
6.电转移缓冲液:含20%甲醇的1×电极缓冲液。
7.漂洗液(TBST):6 mL分离胶缓冲液依次加入0.2 g KCl、1.44g Na2HPO4、0.24 g KH2PO4, 用盐酸调pH至8.0,加水定容至1000 mL。
8.封闭液:含3% BSA的TBST溶液,每组配50 mL。
9.漂洗液(PBS):NaCl 8 g + KCl 0.2 g + Na2HPO4 1.44 g + KH2PO4 0.24 g, 加水定容至1000 mL, 调pH至7.4。
10.显色液:125 mg DAB(3,3-二氨基联苯胺)加入0.05 mM Tris-HCl (pH7.6) 250 mL, 再加1%的过氧化氢溶液1 mL. 要求配制时避光, 现配现用。
11.考马斯亮蓝染色液:0.25 g考马斯亮蓝R-250加500 mL甲醇和70 mL冰乙酸, 加水定容至1000 mL。
12.脱色液:300 mL甲醇和70 mL冰乙酸, 加水定容至1000 mL。
13.蛋白质样品(总蛋白含量2%);第一抗体(使用前用封闭液稀释1000倍);偶联辣根过氧化物酶的第二抗体(使用前用PBS液稀释500倍)。
六、实验步骤
1.制胶:洗净电泳槽、玻璃板、齿梳、橡胶模框并晾干,戴手套安装好电泳槽,用电极缓冲液配1%琼脂煮溶后倒入下电极槽(正极槽),琼脂凝固后开始灌胶。先将10%的分离胶溶液(凝胶母液10 mL、分离胶缓冲液14 mL、重蒸水6 mL、10%过硫酸铵0.4 mL、抽气后加入TEMED 20 μL,混合均匀)溶液倒入凝胶模具内,即两玻璃板之间,达模具高度70%左右,再用1000 μL移液器在凝胶上沿缓慢加入1-2 mL分离胶缓冲液;分离胶凝固后吸去上清液,倒入4%浓缩胶溶液(凝胶母液2.6 mL、浓缩胶缓冲液3.4 mL、重蒸水13 mL、10%过硫酸铵0.5 mL、抽气后加入TEMED 25 μL,混合均匀),插入齿梳,等浓缩胶凝固(约0.5~1.0小时)后倒入电极缓冲液,上极(负极)浸没过浓缩胶上沿,下极(正极)浸没过电极丝。
2.电泳:电泳槽连接电泳仪并通电(10 V);蛋白质样品50 μL与等量上样缓冲液混合后加样,将样孔分为两组进行相同的点样,每孔加样20~50 μL;点样完毕后按每cm凝胶板3 mA进行稳流电泳(电泳过程中电压不超过300 V)。
3.电转移:电泳完毕剥下凝胶并分割为两半,一半用于Western杂交,一半用于考马斯亮蓝染色(20~30分钟后用脱色液脱色);剪一块与凝胶大小相同的NC膜和6块滤纸(不能大于NC膜),浸入电转移缓冲液3~5分钟;将3片滤纸、凝胶、NC膜和另3块滤纸对齐放在两块海绵垫之间,注意各层之间不留气泡;用塑料支架板将滤纸、凝胶及NC膜夹紧后放入电转移电泳槽,NC膜对正极,凝胶对负极,接上电源后在120 mA稳流条件下电泳6小时以上或过夜;电泳结束后取出NC膜并用铅笔在一角作好标记,放置于另一洁净的滤纸上,室温干燥30分钟以上。
4.Western杂交:用TBST漂洗液冲洗NC膜,将两块NC膜放入杂交瓶(蛋白质印迹面背向瓶壁),加入封闭液10 mL,室温下转动杂交瓶2小时;将NC膜放入小塑料袋中,加入用封闭液稀释1000倍的第一抗体(0.1 mL/cm2 NC膜),排气后于4 ºC下缓慢振荡2小时;取出NC膜用PBS漂洗液冲洗3次各10分钟(可在杂交仪上进行),再转移至TBST漂洗液中室温下轻轻振荡10分钟;取出NC膜放入另一塑料袋,加入用PBS液稀释500倍的第二抗体(0.1mL/cm2 NC膜),排气后于4 ℃下缓慢振荡1小时;取出NC膜,用TBST漂洗3次各10分钟(可在杂交仪上进行)后将NC膜放入显色液中,室温下避光轻轻振荡15分钟,用重蒸水洗涤NC膜后转入PBS漂洗液中,应尽快拍照记录以免退色。
注意事项:
(1) 每2组各配1组试剂,做1次膜转移。注意在整个操作过程中手不要接触NC膜,并认清NC膜上印迹面防止膜转移出错。显色反应尽量避光或暗中进行,不要超过20分钟,以免背景色太深而影响拍照。由于实验时程较长,环节较多,最好先制作好各实验步骤时间进程,每完成一个步骤后划线标记。
(2)第一抗体和第二抗体的稀释倍数、作用时间和温度条件对不同的蛋白质有所差异,要经过预实验确定最佳条件。通常第一抗体的稀释倍数在100~5000倍之间,第二抗体的稀释倍数在200~2000倍之间。
(3)显色液必须新鲜配制,最好现配现用,最后才加入H2O2。
(4)DAB有致癌的潜在可能,操作时要小心,不要直接接触。
七、思考题
1. 论述Western杂交的原理与步骤。
2. 论述Southern 和Western杂交的区别。
实训二 cDNA芯片的使用方法—样品制备和杂交
样品制备包括分离和标记两个方面,有些样品还要经过核酸扩增放大这一步骤。样品制备的一般过程是:提取待检样品中的mRNA,反转录成cDNA,同时标记上荧光(荧光标记为最常用的方法)。优点是无放射性且有多种颜色可供使用;研究者可以根据需要选用其它标记方法,例如同位素标记法、化学发光法或酶标法;如果目的是研究两种来源的组织细胞基因的差异表达,则分别提取两种组织细胞的mRNA,反转录成cDNA,分别标记两种不同颜色的荧光(如Cy3和Cy5),等量混合后与芯片进行杂交反应。
杂交反应可以在专用的杂交仪(Hybridization station)或杂交盒(Hybridization chamber)内进行。杂交仪能够容纳多张芯片,有利于杂交过程的自动化和杂交条件的标准化。单个反应可以在杂交盒里进行。
杂交信号检测和分析 通常检测芯片上的杂交信号需要高灵敏度的检测系统——阅读仪(Reader),阅读仪的成像原理分为激光共焦扫描和CCD成像两种。前者分辨率和灵敏度较高,但是扫描速度较慢且价格昂贵。后者的特点与之相反。
【预习思考】
1 讲述生物芯片的种类?基因芯片主要包括哪两种?
2 生物芯片技术主要包括哪几个基本要点?
3 与基因芯片技术相关的仪器有哪些?
【实训目标】
1 了解基因芯片的种类与特点.
2 掌握cDNA芯片的使用方法。
【实训用品】
1 仪器 :General Scanning公司ScanArray 3000扫描仪、Axon公司Genepix 3.0图像处理软件、GSI Lumonics公司Scan Microarray Analysis System、Cartesian公司Cartesian 7500点样仪、硅烷化玻片 TeleChem公司、PCR仪器
2 试剂 Oligo-dT (T15) - Roche 、dNTPs (in buffer 50 mmol/L Tris pH 8、 RNasin - Promega、Superscript II - Life Technologies、Qiaquick PCR purification system - QIAGEN、 22 x 50 mm cover slips、Cot-1 DNA - Life Technologies、Poly dA - Roche、Cy3 and Cy5-dUTP、 0.5mol/L EDTA 、2mol/LNaOH、1mol/L HCl、1mol/L Tris pH 8、100mmol/L sodium acetate、20x SSC、20% SDS 、Deionized Formamide、MilliQ Water、Array chip (5k gene-chip from QIMR)、Hybridisation chamber、DNase-, RNase-free 0.5 and 1.5 mLeppendorf tubes、 Plastic slide holders、2 litre beakers
【实训方案】
(一)实训形式
试液配制、仪器使用、实训记录等,以4人为学习组,每4人一台仪器。
(二)药品配置
组织或细胞样本
Oligo-dT (T15) - Roche
dNTPs (in buffer 50 mmol/L Tris pH 8)
RNasin - Promega
Superscript II - Life Technologies
Qiaquick PCR purification system - QIAGEN
22 x 50 mm cover slips
Cot-1 DNA - Life Technologies
Poly dA - Roche
Cy3 and Cy5-dUTP
0.5mol/L EDTA
2mol/LNaOH
1mol/L HCl
1mol/L Tris pH 8
100mmol/L sodium acetate
20x SSC
20% SDS
Deionized Formamide
MilliQ Water
Array chip (5k gene-chip from QIMR)
Hybridisation chamber
DNase-, RNase-free 0.5 and 1.5 mLeppendorf tubes
Plastic slide holders
2 litre beakers
【实训操作】
总RNA制备---mRNA的分离与纯化---探针标记与纯化---杂交及洗涤---图像处理与数据分析。
【实训现象、数据处理与结果、小结与评议】
(一)现象
(二)数据处理与结果
(三)小结与评议
考核与评价
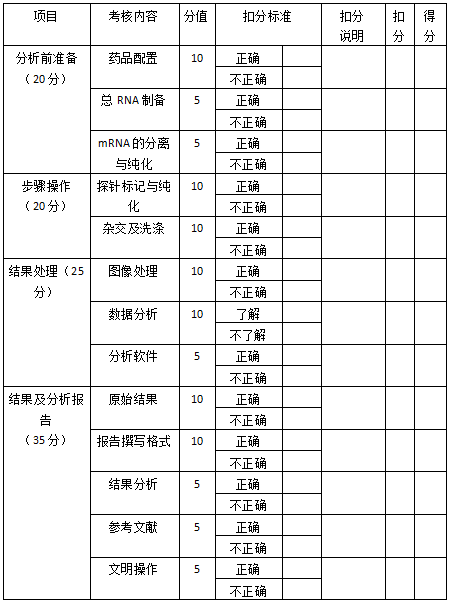
一、操作技能考核
(一)题目
cDNA芯片的使用方法------样品制备和杂交
(二)考核要点
1. 芯片制备方法。
2. 样品的制备过程包括提取、扩增,获取其中的蛋白质或DNA、RNA,然后用荧光标记。
3. 按照操作规程正确操作全部步骤。
4. 信号检测和结果分析。
5. 文明操作。
(三)仪器
General Scanning公司ScanArray 3000扫描仪、Axon公司Genepix 3.0图像处理软件、GSI Lumonics公司Scan Microarray Analysis System、Cartesian公司Cartesian 7500点样仪、硅烷化玻片 TeleChem公司、PCR仪器
(四)试剂
Oligo-dT (T15) - Roche 、dNTPs (in buffer 50 mmol/L Tris pH 8、 RNasin - Promega、Superscript II - Life Technologies、Qiaquick PCR purification system - QIAGEN、 22 x 50 mm cover slips、Cot-1 DNA - Life Technologies、Poly dA - Roche、Cy3 and Cy5-dUTP、 0.5mol/L EDTA 、2mol/LNaOH、1mol/L HCl、1mol/L Tris pH 8、100mmol/L sodium acetate、20x SSC、20% SDS 、Deionized Formamide、MilliQ Water、Array chip (5k gene-chip from QIMR)、Hybridisation chamber、DNase-, RNase-free 0.5 and 1.5 mLeppendorf tubes、 Plastic slide holders、2 litre beakers
(五)实验步骤
(一) 总RNA制备
1组织(或细胞)碾磨粉碎
(1) 将超低温保存的组织(或细胞)材料迅速转移至盛有液氮的碾钵中,用杵子不断碾磨至粉状。
(2) 称取1.5g粉状样品,放入盛有液氮的碾钵中,并加入50ml溶液D,用杵子不断碾磨至细粉状。
2组织匀浆
(1)将碾好的细粉末倒入匀浆管中,在组织匀浆粉碎机上匀浆。
(2)将匀浆液分装在离心管中,冰浴20min。
(3)11000×g离心5min,将上清转移入另一离心管。
3分离和沉淀
(1)分别加入1/10体积3mol/LNaAc(pH4.5)和等体积5:1酸性酚氯仿溶液,冰浴20min后, 4℃,11000×g离心20min。
(2)吸取上清至一50mL离心管,加入等体积异丙醇,混匀后-20℃放1小时。
(3) 4℃,11000×g离心20min,弃上清。
(4)每管加入3mL的溶液D,溶解沉淀,再用等体积的酚氯仿各抽提一次。
(5)加等体积的异丙醇,-20℃沉淀2小时。4℃,10000×g离心20min,弃上清。
(6)加入10mL冰预冷的75%乙醇,洗涤沉淀2次,晾干沉淀。
4溶解和比色
(1)按照0.5mL/g组织的比例加入Milli-Q水200mL,彻底溶解沉淀。
(2)取适量的样品用10mol/mL的Tris稀释一定倍数,测分光光度值。一般来说ratio(260与280的比值加320系数)值,在1.80~2.00之间比较好。
(3)配1.0% 的胶,取500ng样品做电泳鉴定。
(二) mRNA的分离与纯化
1 称取一定量的oligo(dT)-纤维素,悬浮于1×上样缓冲液中。
2 将悬浮液装入填有经DEPC处理并高压灭菌的玻璃棉的1mL玻璃注射器中,柱床体积0.5~1ml,用10mlDEPC处理的水冲洗。柱床体积为1mL的oligo(dT)-纤维最大载样量为10mg总RNA,如总RNA的量较少,则应减少柱床体积。
3 用5倍体积的0.1mol/L的NaOH洗柱,然后再用5倍体积的ddH2O冲洗柱子。
4 用10倍床体积的洗脱缓冲液平衡柱子。
5 用10倍床体积的上样缓冲液平衡柱子,备用。
6 用ddH2O溶解RNA样品,68℃水浴3min后迅速插入冰浴中,加等体积的2×上样缓冲液,上样,然后收集流出液。
7 当全部溶液快流干时,将流出液置于68℃水浴3min后,迅速冷至室温后重新上样,并收集流出液。
8 用大量的1×上样缓冲液洗柱,直至OD260值很低或为零。
9 待上样缓冲液快流干时,加洗脱缓冲液洗柱,用1.5mL离心管分管收集,每管约400μL,共收集6管,通常mRNA洗脱峰集中在第2管中,第3管次之,第4管后就很少,而第1管中几乎没有RNA洗脱下来。
10 用分光光度计测OD260值,合并mRNA的洗脱组份。加入1/10 3mol/LNaAc(pH5.2)和3倍体积无水乙醇,混合后-80℃保存备用。
11 用时取出,4℃,12000r/min离心20min,弃上清,70%乙醇洗涤2次,沉淀中温烘干,备用。
(三) 探针标记与纯化
1将如下试剂混合:
17μL 25ug 总RNA或1~5μg mRNA
1μL RNasin核酸酶抑制剂
2μL Oligo dT (2 μg/μL)
2 加热到70℃ 10 min.,冰浴1 min。
3 将如下试剂混合:
8μL 5x RT buffer
4μL DTT
1μL dATP, dCTP, dGTP (各 25mmol/L)
2μL dTTP (2.5mmol/L)
2μL Cy3(对照组样本)1mmol/L 或 Cy3-dUTP (实验组样本)1mmol/L
4 将上述混合液与RNA + oligo dT 液混合,振荡后冰浴,加入1.5μL Superscript II。反转录酶,60℃孵育60 min 。
5 加入1μL的Superscript II反转录酶,孵育30 min.后,冰浴1 min。停止反应。
6 加入1μL 的0.5mol/L EDTA 和 2μL 的 2 mol/L NaOH.,65℃加热10 min,水解除去RNA。
7 加入4μL的1 mol/L HCl 和 4μL 1 mol/L Tris pH 8。
8 加入17μL的100m mol/L 醋酸纳至各反应管。
9 使用Qiaquick PCR purification kit纯化。
(四) 杂交及洗涤
1将如下试剂混合
Cy5+Cy3 probe 30μL
Poly d(A) (8mg/mL) 1μL
Yeast tRNA (4mg/mL) 1μL
Human C0t-1 DNA (10mg/mL) 1μL
20x SSC 6μL
50x Denhardt’液 1μL
用microcon 30 filter 浓缩探针混合物,使终体积为12μL或略少
2芯片先经含有0.5mg/mL鱼精DNA的杂交液在42℃预杂交6h。
3杂交探针在95℃水浴中变性5 min,14.000 g 离心10min。
4探针加在基因芯片的点样区域上,用盖玻片封片,置于42℃杂交15~17h。
5用洗涤2×SSC+0.2%SDS冲洗玻片,去除盖玻片。
6准备两个染色缸,分别装有2×SSC+0.2%SDS,0.1×SSC+0.2%SDS放入60℃水浴锅中。
7将玻片依次浸入以上两个染色缸中洗涤10min。
8再将玻片浸入装有0.1×SSC的烧杯中洗涤5min,晾干后扫描。
注意事项:每点的DNA的数量 = 样本的浓度 × 每点的量
斑点的容量少意味着用于杂交的探针的数量也很少,即使样本的浓度很高。必须努力减少这样的限制。一些因素必须考虑到,除了探针DNA的数量外,还有与目标分子相互补的探针DNA的比例,长短,目标分子的活性,就象用于检测信号方法的灵敏度影响着信号的强度。
杂交信号的浓度是与目标分子活性成比例的,与它的长度成反比,因此目标分子的特殊活性是十分重要的。每次实验的杂交时间也应该精确测量。
(五) 图像处理与数据分析
用ScanArray 3000扫描芯片,用Genepix软件分析荧光信号强度, 为了避免信号值过低带来误差,只有那些Cy3或Cy5大于800的点被选出进行后续分析,并根据软件提供的校正系数对整张芯片的荧光信号值进行校正。 对于芯片上各点都采用Cy5/Cy3的比值作为ratio值,ratio值大于2.0或者小于0.5的点被认为是有表达差异的基因,利用芯片上点的管家基因的信号强度值校正芯片之间的差异,使用各种统计软件进行聚类分析等。
二、技能考核评分表
操作评分细则