DNS法及聚酰胺薄膜层析技术测定蛋白质N—末端和蛋白质的氨基酸组成分析
一、目的:
学习DNS法及聚酰胺薄膜层析法测定蛋白质N—末端和蛋白质的氨基酸组成的原理及技术。
二、原理:
DNS—Cl在碱性环境里蛋白质和肽的α-氨基酸的氨基起反应,生成带有荧光的、稳定的DNS-氨基酸
(参看图19-1,19-2),其反应如下:
蛋白质在水解前与DNS—Cl反应,产生DNS-蛋白质,它标记在N-末端氨基酸残基上,经水解和薄层层析而测知是何种氨基酸。蛋白质水解后与DNS—Cl反应,标记的是蛋白质的氨基酸组成成分,如图19-1和图19-2所示。这是一种较为简便的、适用的蛋白质的氨基酸组成成分分析的方法。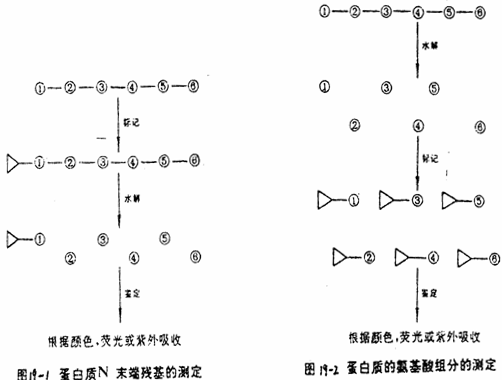
DNS-蛋白质水解产物中包括下列DNS-衍生物:相当于N-末端的α-DNS-氨基酸,从链内赖氨酸及酪氨酸残基形成的ε-DNS-赖氨酸和O-DNS-酪氨酸,这些衍生物相当稳定。此外,DNS—Cl还与溶液中的氨起反应生成DNS—NH2,DNS-磺酰胺以及DNS—Cl水解生成的DNS—OH(DNS-磺酸)。
此法与氟二硝基苯法相比,有二个突出的优点,即水解产物无需提取,可用电泳或层析法直接鉴定氨基酸;另外就是灵敏度高,DNS-氨基酸的最大荧光激发值约为550nm,由于其荧光十分强烈,1—5n mol·L-1或0.2—1.0n mol·L-1 DNS-衍生物即可分别用电泳或薄层层析容易地检测。
DNS—Cl能与所有的氨基酸生成具荧光的衍生物。其中赖氨酸、组氨酸、酪氨酸、天冬酰胺等氨基酸可与DNS—Cl生成双DNS-氨基酸衍生物。这些氨基酸相当稳定,可用于蛋白质的氨基酸组成的微量分析,灵敏度达10—9—10—10摩尔水平。比茚三酮法高10倍以上,比过去常用的氟二硝基苯(FDNB)法高100倍。
DNS-蛋白质(或肽),在5.7mol·L-1 HCl,110℃水解16—20h,DNS-蛋白质的肽键被打开。由于DNS基团与氨基之间的键结合牢固,绝大部分DNS-氨基酸都抗水解。除DNS-色氨酸全部被破坏;DNS-脯氨酸(77%),DNS-丝氨酸(35%),DNS-苏氨酸(30%),DNS-甘氨酸(18%),DNS-丙氨酸(7%)部分被破坏外,其余DNS-氨基酸很少破坏。
DNS—Cl与蛋白质的侧链基团巯基、咪唑基、ε-氨基和酚反应,前两者在酸碱条件下均不稳定,酸水解时完全破坏;DNS-ε-赖氨酸和DNS-O-酪氨酸较稳定,同时还有DNS-双-赖氨酸和DNS-双-酪氨酸生成,展层后在层析图谱的位点上,都与DNS-α-氨基酸有区别。
DNS—Cl在pH过高时,水解产生副产物DNS-OH,即: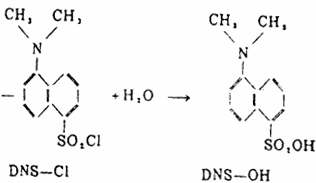
在DNS—Cl过量时,会产生DNS—NH2,即:
DNS—OH在紫外光下产生蓝色荧光,DNS—NH2的位点往往和丙氨酸重合,在本实验条件下,需进行第三相展层。
根据鉴定方法需要,DNS—Cl的浓度5m mol·L-1(约每ml2.0mg丙酮溶液),保存在棕色瓶中,置避光处防止分解。样品浓度大约1m mol·L-1。反应液要求丙酮浓度50%,pH8.5—9.8,以保证游离氨基等功能团非质子化。在37℃保温,黄色消退即表示反应完全,一般约0.5h—1h。反应完后,混合物中含有较多DNS—OH,最好除去副产物后再水解DNS-蛋白质或肽。蒸干除去丙酮,加5.7mol·L-1 HCl,抽真空,封管在110℃水解20h,除去盐酸,加丙酮溶解点样展层,在紫外灯下鉴定荧光产物,同标准图谱比较,可区分未知DNS—氨基酸的种类。根据氨基酸的种类和数量可提供被测蛋白质或肽样品的纯度、肽链的数量和N-末端氨基酸的性质等方面的有价值的资料。
聚酰胺薄层层析鉴定DNS—氨基酸。展层后可鉴定所有的DNS—氨基酸。聚酰胺是一类锦纶的化学纤维原料(或称尼龙)。由己二酸与己二胺聚合而成的叫作锦纶66:![]()
由己丙酰胺聚合而成的叫作锦纶6:
聚酰胺薄膜。
聚酰胺薄膜的酰胺基团可与被分离物质之间形成氢键,因此对极性物质有很强的吸附作用(图19-3)。被分离物质与酰胺基团形成氢键能力的强弱,确定了吸附能力的差异。在层析过程中,展层溶剂与被分离物质在聚酰胺表面竞相形成氢键,选用适当的展层溶剂,使被分离的各种物质在溶剂与聚酰胺表面之间的分配系数有较大差异经过吸附与解吸的展层过程,形成一个分离顺序,彼此分开。选择适当的溶剂系统在5×5cm大小的薄膜上双向层析,大部分氨基酸可有效地分开。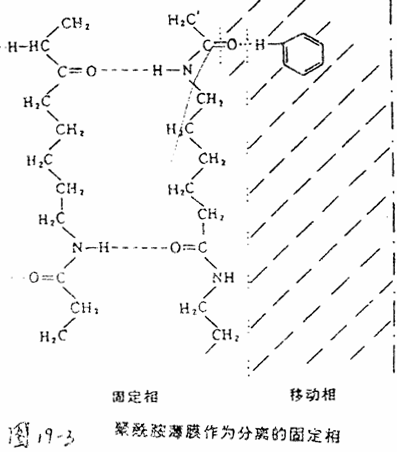
DNS-氨基酸的分离和鉴定:
1.溶剂系统
第Ⅰ相展层溶剂系统(1):甲酸(88%)∶水=1.5∶100(V/V)
第Ⅱ相展层溶剂系统(2):苯∶冰乙酸=9∶1(V/V)
第Ⅲ相展层溶剂系统(3):乙酸乙酯∶甲醇∶冰乙酸=20∶1∶1(V/V)
第Ⅳ相展层溶剂系统(4):0.05mol·L-1磷酸三钠∶乙醇=3∶1(V/V)
2.混合标准DNS-氨基酸图谱
(1)DNS-氨基酸混合样品,经双向展层后大部分可得到分离(如图19-4),第Ⅰ相用溶剂(1),第Ⅱ相用溶剂(2)。
(2)DNS-天冬氨酸(Asp)和DNS-谷氨酸(Glu);DNS-丝氨酸(ser)和DNS-苏氨酸(Thr);DNS-精氨酸(Arg)和DNS-组氨酸(His);DNS-α-赖氨酸(Lys)和DNS-ε-赖氨酸(Lys)可能分不开;DNS-丙氨酸(Ala)和DNS-NH2也可能重叠在一起。为了分离这些DNS化的氨基酸,可用溶剂(3)在第Ⅱ相再展层一次(图19-5)。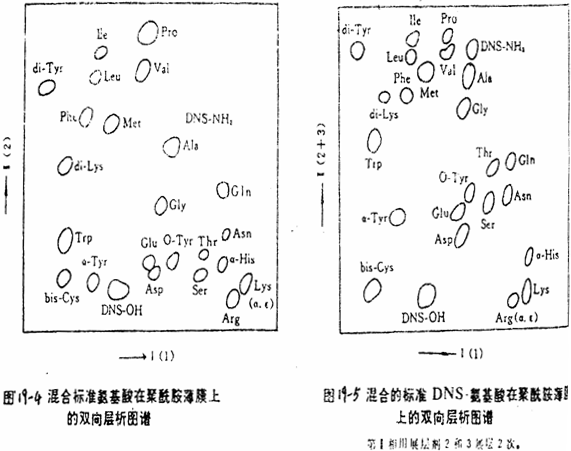
3)经过3次展层,有时,α组氨酸和精氨酸,α和ε赖氨酸分离还不完全,可用溶剂系统(4)在第Ⅱ相再展层一次(图19-6)。
3.猪胰岛素N-末端氨基酸残基图谱和氨基酸组成
(1)猪胰岛素N—末端分析(图19-7)。猪胰岛素由2条肽链组成,因此,纯的猪胰岛素有2个N—末端氨基酸,即甘氨酸和苯丙氨酸。还有两种非N—末端的氨基酸,即酪氨酸和赖氨酸。在紫外灯下可见到DNS-Gly和DNS-Phe,同时还可见到O-DNS-Tyr,ε-DNS-Lys。
(2)猪胰岛素氨基酸组成图谱(19-8)。猪胰岛素氨基酸组成包括:Gly,Phe,Leu,Ile,Pro,Val,Ala,Cys,Glu,Asp,Thr,Ser,His,Arg。胰岛素氨基酸组成中,Asp和Asn,Glu和Gln是分辨不出来的,因为经过水解之后,氨基酸的酰胺化合物都转变成为相应的酸,Trp(Try)也完全被破坏,测不出来。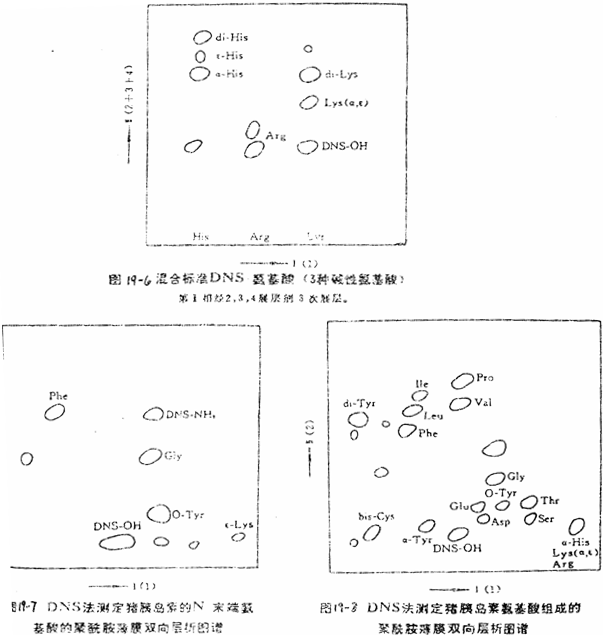
测N-末端时,如果丹磺酰化完全得到负结果,则很可能此样品的N-末端是Trp,因为Trp的DNS-衍生物盐酸水解时全部被分解。丹磺酰化后的肽或蛋白质用链霉蛋白酶水解,则能很容易地检测出Trp。
鉴定DNS-氨基酸,可用夹心型的聚酰胺薄板,即板的两面都涂有聚酰胺薄膜,板的一面点上待检样品;另一面点上标准样品。展层后,利用板的透明性鉴定未知DNS-氨基酸。一般情况下,如无这种薄板,则利用所得到的图与标准的图谱进行比较,有时还要计算相对迁移率,然后才鉴定氨基酸的种类。
DNS法鉴定肽和蛋白质的N-末端氨基酸或它们的氨基酸组成是比较方便,也比较灵敏的。但由于聚酰胺薄膜的质量不能保证完全一样,或者展层溶剂系统产生一些细微变化,这时所得图谱与标准图谱也会有差异,这就需要进一步证实差异原因,重复实验。
酪氨酸DNS化时,一般产生3种DNS化产物,即α-DNS-Tyr的黄色荧光同一般的DNS氨基酸差不多,而O-DNS-Tyr和di-DNS-Tyr带有亮黄色荧光。这3种产物展层后分离得比较开(图19-9)。如果Tyr的DNS化产物和甘氨酸、苯丙氨基酸DNS化产物一起展层,是到如图19-10的结果。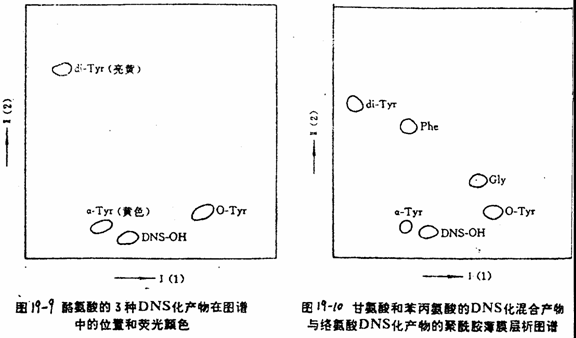
三、器材及试剂:
1.器材:
紫外灯,恒温水浴,小型干燥器(或400ml平底烧杯),烧杯,电炉,真空泵,塑料膜,水解管,磨口小试管,毛细管,聚酰胺薄膜。
2.试剂:
①DNS—Cl丙酮溶液:2—5mg DNS—Cl溶在1ml丙酮中,棕色瓶封口,暗处保存,数月稳定。买的商品可能含有一些白色不溶物质(水解产物DNS—OH),这种物质在试剂的保存期间也会慢慢产生。如果水解程度很少,对实验不会有很大影响(不会有很大干扰)。
②0.2mol·L-1 NaHCO3缓冲液(pH9.5):用Na2CO3和NaHCO3配制(Na2CO3∶NaHCO3= 3∶7)。
③5.7mol·L-1 HCl:用优级纯HCl配制。
④展层液:第Ⅰ相展层溶剂系统(1):甲酸(88%)∶水=1.5:100(V/V)
第Ⅱ相展层溶剂系统(2):苯∶冰乙酸=9∶1(V/V)
四、操作步骤:
1.丹磺酰化技术
(1)DNS—氨基酸制备:用0.2mol·L-1 NaHCO3缓冲液配成2m mol·L-1 浓度的氨基酸溶液。取0.1ml加入具塞玻璃试管中,同时加入0.1ml DNS—Cl丙酮溶液(2.5mg·ml-1),反应要求最终浓度为氨基酸1m mol·L-1,DNS—Cl 5m mol·L-1 ,丙酮5%(pH8.5—9.8)。用1mol·L-1 NaOH调pH9—10,塞紧摇匀。置37℃保温1h,反应完成后放暗处保存,备用。
(2)多肽和蛋白质N-末端DNS化氨基酸溶液的制备:用0.2mol·L-1 NaHCO3溶液配制2m mol/L多肽或蛋白质溶液。取0.1ml此溶液加入水解管中,加入0.1ml DNS—Cl丙酮溶液(2.5mg·ml-1),用1mol·L-1 NaOH调pH9—10,混匀后用parlfin封口,置37℃保温1h。反应完成后,蒸干丙酮,加5.7mol·L-1 HCl,抽真空封口,110℃保温16—20h,水解完成后,开管将溶液转移到5ml小烧杯内,蒸干盐酸,加几滴水再蒸干,反复数次使盐酸完全除净。用丙酮溶解样品、点样展层,即可得到样品的N-末端DNS-氨基酸。
(3)多肽和蛋白质DNS化氨基酸组成的溶液的制备
● 水解肽和蛋白质:取0.1ml 2m mol·L-1的多肽或蛋白质溶液,加入水解管中,再加优级纯盐酸,使盐酸浓度达到5.7mol·L-1,抽真空封口,置110℃水解16—20h(最好分别水解24,48,72h),水解完成后,开管转移到5ml烧杯内,置沸水浴中蒸去盐酸,干后加几滴蒸馏水,继续蒸干,反复数次除净盐酸。
● 水解氨基酸DNS化:加入0.1ml 0.2mol·L-1 NaHCO3和0.1ml DNS—Cl丙酮溶液,用1mol·L-1 NaOH调pH9—10,转移到具塞磨口试管中,置37℃保温1h,到此,肽和蛋白质DNS化的氨基酸组成的样品制备完成,即可点样展层。
此法与二硝基化苯相比的优点是,水解后无需提取水解产物,可用于电泳或层析法直接鉴定氨基酸,且灵敏度高。
2.以聚酰胺薄层层析鉴定DNS-氨基酸
(1)选择聚酰胺薄膜:聚酰胺薄膜有夹心式(即两面都涂有聚酰胺的板)和单面聚酰胺薄膜,单面的有4×4cm,7×7cm,5×15cm和7×11cm等几种规格。本实验选用4×4cm或7×7cm均可,并要求质地均匀,与尼龙板贴附牢固,无剥脱现象。
(2)点样:将粗细合适的毛细管用沙纸或砂轮将较齐的一头磨平,小心地将样品点在薄膜的右下角,距离边缘0.5cm的地方。样品点要求圆、小,不能把膜触破,最好一次点样成功,即在一处只点一下,因此样品的浓度要合适,如果浓度不够,则需重复在一处多次点样,即在第一次点样后,用吹风机吹干再点第二次、第三次等,在膜上标记。展层第一相样品在右下角,展层后彻底吹干,将膜顺时针转90°,即样品原点转到左下角展层第二相。
(3)展层
● 点样后在小的干燥器里进行展层,首先要在干燥器盖的边缘涂一薄层凡士林,使之密闭不漏气,放入培养皿并调水平。
● 向培养皿里加入展层剂,溶剂高度不超过3cm,盖上干燥器盖,使溶剂蒸汽在干燥器内达到饱和。
● 用皮筋或线将点好样的薄膜捆成半圆筒型,并能垂直放稳,皮筋不接触膜,膜在板的内面,即光面在外与皮筋接触。打开干燥器盖,将捆好的薄膜垂直放入盛有展层剂的培养皿里,立即盖好盖,溶剂即向上展层,当溶剂上升到离膜顶端0.5cm处时,停止展层,立即开盖标记前沿,取出,彻底吹干后顺时针旋转90°,以同样方法进行第Ⅱ相展层(用第(2)溶剂系统或根据需要可在溶剂系统(3)中展层)。
五、结果讨论:
绘制出层析图谱,并分析说明该蛋白质样品是由几条链组成?其末端—氨基酸是什么?其氨基酸组成如何?
六、注意事项:
1.制备的条件
在DNS-氨基酸制备时,DNS化必须在碱性条件下(pH9.7—10.5)进行,否则会有很多副产物DNS—NH2或DNS—OH产生。
测蛋白质或肽的N-末端氨基酸时,可用透析或Sephadex G-25,G-15,G-10层析,除去DNS-OH和DNS-NH2及小分子物质再水解。
2.封管水解的几个问题
(1)DNS化后,加5.7mol·L-1 HCl水解,一定要抽真空封管。否则110℃水解时易氧化破坏氨基酸。
(2)水解后一定要把HCl彻底除净。
3.点样展层
(1)点样:样品的点要小、圆、量要适当,否则拖尾,因此毛细管要细,头要平,样品浓度要合适,聚酰胺薄膜要选择优质的。
(2)展层要在小的、密闭的、底部水平的容器里进行,每次展层的温度、时间、展层剂的浓度要保持一致,否则不易重复。
4.鉴定未知样品的N-末端氨基酸
(1)内标法确定未知样品N-末端氨基酸:在一块薄膜上点未知的DNS-氨基酸,第二块膜上点已知标准DNS-氨基酸,第三块膜上将未知的和已知的同时点在一点上,展层后观察,如果在第三块膜的荧光加强并重合,表明此未知氨基酸同已知标准DNS-氨基酸一样,否则为不同的氨基酸。
(2)采用夹心型的聚酰胺薄膜,其膜的两面都涂有聚酰胺,可在一侧面点上待测的DNS-氨基酸;另一侧面点上对照的标准DNS-氨基酸。层析后可利用板的透明性质,比较、鉴定未知的DNS—氨基酸。