定量PCR的应用与开发
提要
1.应用开发指南
2.引物设计软件
3.实验设计思路
4.技术应用举例
应用开发指南
应用开发基本流程

•探针设计指南
–免费赠送Primer Express软件
–TaqMan探针Tm68ºC -70ºC
–MGB探针Tm65ºC -67ºC
•引物设计指南
–引物Tm58ºC -60ºC
–短PCR产物50-150bp
•PCR程序指南
–通用的PCR条件 2步法:95ºC @15sec, 60ºC @ 1 min
•实验条件快速优化指南
–所有实验在同样条件下完成
–固定的PCR试剂浓度2X TaqMan®Universal PCR Master Mix
–只需简单优化引物/探针浓度
引物设计指南
1.先设计探针,再设计引物;
2.引物要尽可能地接近探针,但是不可与探针重叠;
3.G-C含量保持在30-80%之间;
4.避免同一碱基重复过多,特别是不可有连续4个或更多的G;
5.用Primer Express®软件计算出来的Tm值应当在58-60 ℃之间;
6.在引物3’端的倒数5个碱基中,G和C加起来不要超过2个。
为什么要避免3’端的G和C?
Design rule:5 nucleotides at the 3' end have only 1-2 G+C’s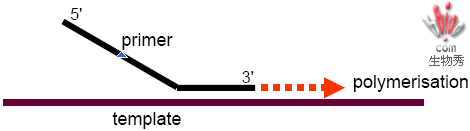
Transient binding at 3' end of probeis quickly stabilised by the DNA polymerase
MGB探针设计指南
1.探针的5' 端第一个碱基不能是G;
2.用Primer Express®软件计算出来的MGB探针Tm值在65 -67°C 之间;
3.探针要尽可能地短,但是不要短于13个碱基;
4.避免同一碱基重复过多,特别是不可有连续4个或更多的G;
5.C比G多的探针效果更好,如果C少于G,则使用互补链;
6.检测SNP或者基因突变,多态或突变位点尽量位于探针中央,可以±3个碱基并在倒数第二个碱基之前。
探针设计指南
基因表达、cDNA定量研究,特别设计探针跨过两个外显子,增强反应特异性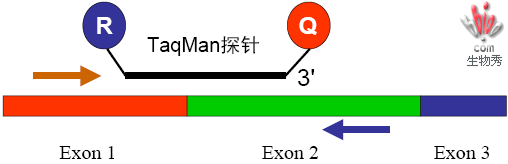
为什么探针要C比G多?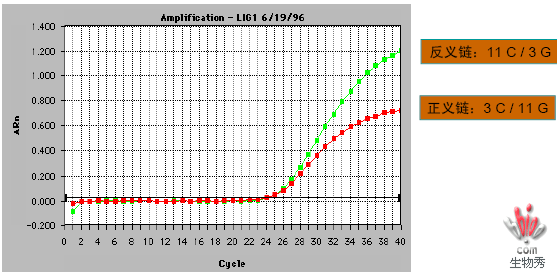
MGB探针设计指南
SNP和基因突变位点在MGB探针中的位置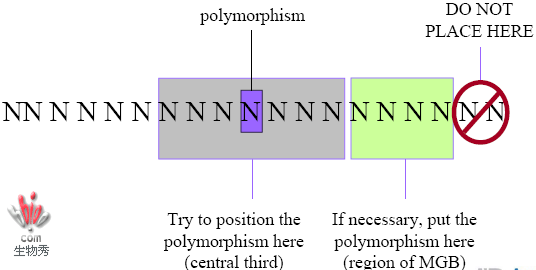
Primer Express软件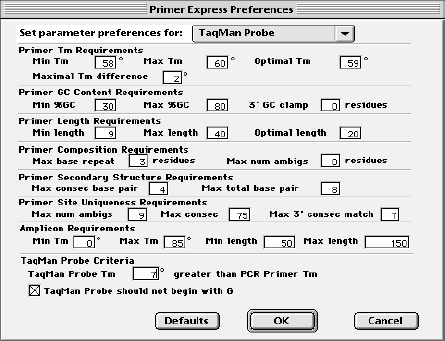
探针的荧光标记
热循环程序指南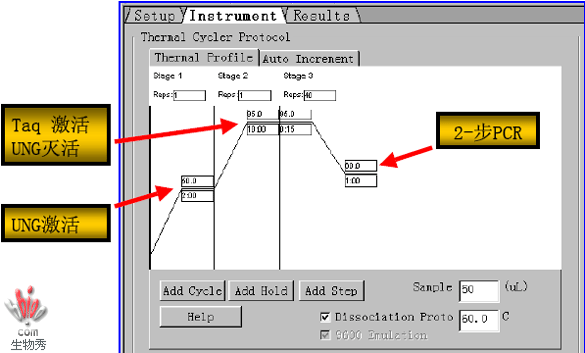
引物浓度优化指南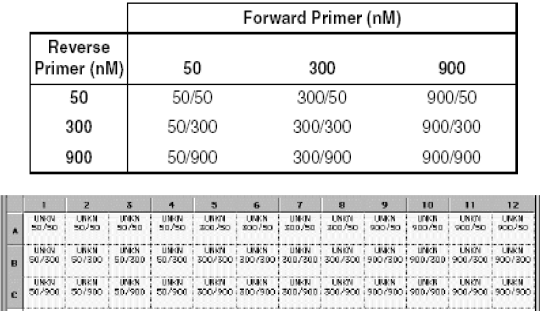
引物浓度优化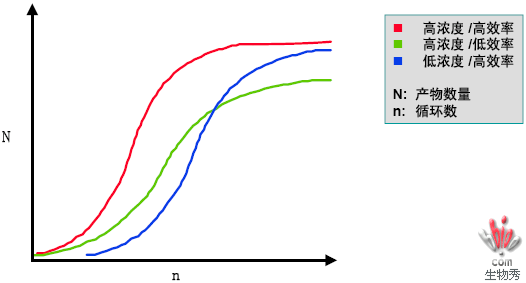
探针浓度优化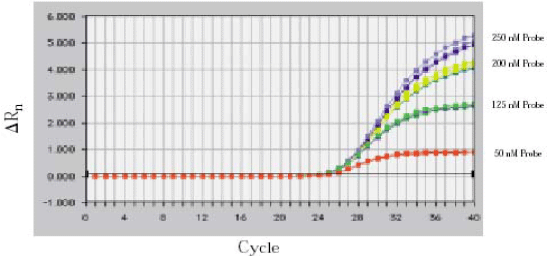
Lowest Ct and highest delta Rn is better
定量PCR基本流程
1.准备模板(DNA或RNA,RNA反转录成cDNA)
2.PCR反应(DNA/cDNA+引物探针+PCR mix)
3.填样品表(样品名、孔位,样品类型、探针颜色)
4.设置参数(循环参数、反应体积、熔解曲线)
5.运行PCR,自动分析数据
6.进一步分析数据(基线、阈值、CT值、相对表达等)
DNA反应体系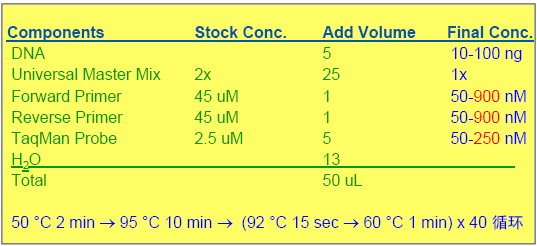
反应体积:96孔板25 -50 uL;384孔板5 -20 uL
cDNA反应体系
反应总体积:96孔板25 -50 uL;384孔板5 -20 uL
实验设计思路
实验设计策略
中医中药现代化
•实验方案设计
–选择具有免疫调节功能的中药单方或配伍(1方)
–选择免疫相关基因(5个)
–选择对该中药反应敏感的实验对象(50人)
服药前(对照)、服药后不同时间点(共5点)
–RNA /cDNA制备:选择外周血或者特异的免疫组织(2种)
–反应总数:5个基因x 50人x 5个时间点x 2种组织x 6次重复= 15000
•所需资源预算
–7000型定量PCR仪(1台)
–96孔板160块,按每天4块计算,1个半月完成(40天)
–试剂:网上定购5种基因表达试剂盒(20 x,250 uL/kit)
(10uL/rxn, 500 rxn/kit x 6 kit= 3000 rxn/gene)
TaqManUniversal PCR Master Mix试剂盒
(2000反应/kit/25 uL,10uL 5000反应x 3 kit)
反转录试剂盒(共500rxn, 200 rxn/kit x 3 kit)
SNP与表现型
Classic Association Studies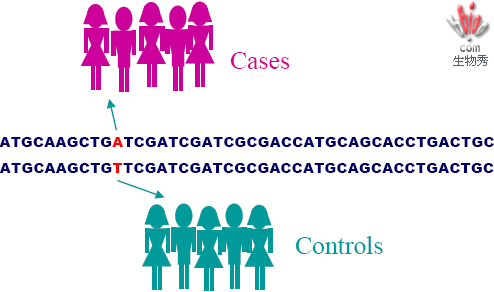
肝硬化的个体差异
•假设前提:人胶原IV基因及其调控序列的多态性是肝硬化个体差异的原因之一。
•实验方案:
–SNP位点:在人胶原IV基因上挑选8个SNP位点
>调控序列,外显子,剪接点,Block
–样本组:50个病人+ 50个正常对照
–DNA提取:外周血
–反应总数:800个
•成本估算:
–时间:大约10块96孔板,3天完成
–试剂:定购8种SNP试剂盒或代客合成服务
肝硬化个体差异结果分析
•正常组50人:AA 38,AG 10,GG 2
•疾病组50人:AA 20,AG 10,GG20
•3X2 卡方统计分析,计算P值
–小于0.05:显著差异
–小于0.01:非常显著
•讨论:
–该位点GG纯合子基因型可能与肝硬化的发生有关系
–如果是随机选择的SNP位点,则致病基因可能位于该位点附近
–如果临床诊断或分类不准确,则结论站不住脚
免费软件SNPbrowser
SNP字典:全部4百万个人类SNP位点,4万个人类基因
中国人、日本人、白人、黑人4个人群的单倍型信息
免费下载:www.allsnps.com
与药效相关的SNP研究
个体化用药
药物作用的靶位点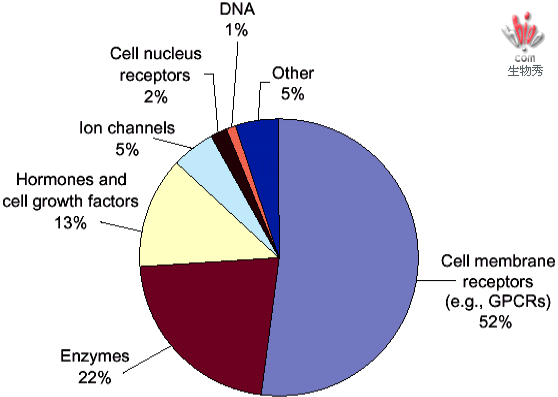
技术应用举例
I类应用:实时定量
II类应用:终点读板
•基因突变分析
–单基因遗传病诊断,如血友病、地贫
•SNP扫描
–疾病相关基因鉴定,如牛皮癣、哮喘相关基因SNP的鉴定
–SNP检测与临床表现的相关性,如抗高血压药物疗效的个体差异
–药物副反应的预防,如麻醉意外
•物种鉴定、菌株鉴定
–各种病毒,细菌,病毒
–病原体检测,如炭疽菌,E coli. O157
荧光定量PCR的临床应用
•遗传疾病的早期诊断 肿瘤的诊断
•抗病毒药物疗效的观察、指导
•病情评估和预后判断
•新药验证 输血源的筛选
•母婴传播的控制与观察
同步定量PCR在醫學和生物學领域的全方位應用 |
定量病人血漿中的EBV病毒
1999,香港中文大學病理系,Dr. Dennis Lo
研究结论:
EBV是導致鼻咽癌的主因之一
實驗結果:
1.96%的病人可被偵測得到EBV之存在
2.鼻咽癌晚期的EBV DNA量比早期較高
3.放射線治療後,EBV DNA無法被偵測
4.ABI 7700定量PCR方法可應用於監測療程中之病毒量變化
偵測HCV之病毒量
--1999,Dr. Tomoko Takeuchi,Japan
--HCV是導致肝病變的原因之一
--實驗結果:
a. 98%的病人於慢性肝炎期可被偵測到HCV之存在
b. 95.8%的病人於肝壞疽期可被偵測到HCV之存在
c. 100%的病人於肝細胞腫瘤期可被偵測到HCV之存在
d. 利用干擾素治療前後來偵測HCV病毒之改變量
偵測病人痰中的肺結核桿菌量
--1998,Dr. L. E. desjardin,USA
--Mycobacterium tuberculosis是導致肺結核(TB)的主因之一, 而病人經抗結核桿菌治療後, 仍長期出現在痰中
--實驗結果:
a. 偵測TB IS 6110 target gene
b. 傳統瓊酯膠培養耗日廢時(6~8週)
c. 可用來定量早期肺結核的量
偵測病人活體組織與子宮頸抹片的HPV病毒量
--1999,Dr. Agnetha Josefsson,Sweden
--人類乳突狀病毒(HPV)是導致子宮頸癌的幫凶,臨床症狀顯示,有HPV感染者,未必罹患有子宮頸癌,但罹患有子宮頸癌之患者,90%有HPV感染
--實驗結果:
a. 針對HPV type 16,18,31,33,35,45進行篩檢